Descubre la fascinante diferencia entre metal y no metal
En el mundo de la química, existen dos categorías principales de elementos: los metales y los no metales. Cada uno de ellos posee características y propiedades únicas que los distinguen y los hacen aptos para diferentes aplicaciones. En este artículo, exploraremos en detalle qué es un metal y qué es un no metal, así como las diferencias entre ellos y sus usos más comunes en la sociedad.
¿Qué es el metal?
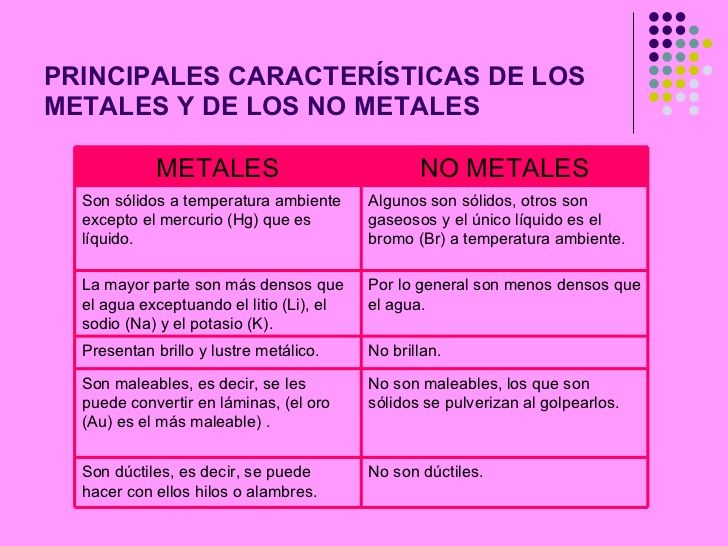
Los metales son elementos químicos que se caracterizan por ser buenos conductores de electricidad y calor. Poseen una estructura atómica en la que los electrones se encuentran en una nube llamada "mar de electrones", lo que les confiere sus propiedades conductoras. Además, suelen ser sólidos a temperatura ambiente, son maleables, es decir, se pueden modificar su forma sin romperse, y son brillantes.
¿Qué es el no metal?
Por otro lado, los no metales son elementos que no poseen las características de los metales. En general, son malos conductores de electricidad y calor, y suelen ser opacos. Además, pueden presentar diferentes estados de la materia, como sólidos, líquidos o gases, y suelen tener propiedades no metálicas, como baja maleabilidad y ductilidad.
- Propiedades de los metales
- Propiedades de los no metales
- Principales diferencias entre metal y no metal
- Usos comunes de los metales
- Usos comunes de los no metales
- Metales y no metales en la tabla periódica
- Reacciones químicas de metales y no metales
- Conductividad eléctrica y térmica
- Metaloides
- Metalurgia
- Conversión de metales a no metales
- Intercambio iónico
- Conclusión
- Preguntas frecuentes
Propiedades de los metales
Maleabilidad
La maleabilidad es una de las propiedades más destacadas de los metales. Esto significa que los metales pueden deformarse sin romperse, es decir, se pueden martillar o laminar para obtener láminas delgadas. Esta propiedad es especialmente útil en la industria de la construcción y en la fabricación de utensilios.
Ductilidad
La ductilidad es otra característica importante de los metales. Esta propiedad se refiere a la capacidad de los metales para estirarse en hilos delgados sin romperse. Un ejemplo común de un metal ductil es el cobre, que se utiliza en la fabricación de cables eléctricos.
Conductividad eléctrica
Los metales son excelentes conductores de electricidad debido a la forma en que sus electrones se mueven en su estructura atómica. Los electrones libres en los metales pueden moverse fácilmente a lo largo del material, lo que permite el flujo de corriente eléctrica. Esta propiedad es fundamental en la fabricación de cables y en la industria electrónica.
Conductividad térmica
Al igual que la conductividad eléctrica, los metales también son buenos conductores de calor. Esto se debe a que los electrones libres pueden transferir energía térmica rápidamente a través del material, lo que permite una rápida dispersión del calor. Esta propiedad es esencial en aplicaciones como la fabricación de recipientes para cocinar y el enfriamiento de dispositivos electrónicos.
Brillo metálico
Los metales tienen un brillo característico, conocido como brillo metálico. Esto se debe a la forma en que la luz interactúa con los electrones en la nube electrónica de los metales, lo que les confiere un aspecto brillante y reflectante. Este brillo metálico es apreciado en aplicaciones como la joyería y la decoración.
Propiedades de los no metales
Opacidad
A diferencia de los metales, los no metales suelen ser opacos y no permiten el paso de la luz a través de ellos. Esto se debe a su estructura atómica y a la forma en que interactúan con la luz. Algunos ejemplos de no metales opacos son el carbono y el fósforo.
No conductividad eléctrica
Los no metales son malos conductores de electricidad. Esto se debe a que no tienen electrones libres en su estructura atómica que puedan moverse y llevar la corriente eléctrica. Esta propiedad hace que los no metales sean utilizados como aislantes en la fabricación de cables eléctricos y componentes electrónicos.
No conductividad térmica
Al igual que con la electricidad, los no metales también son malos conductores de calor. Esto significa que no pueden transferir energía térmica rápidamente a través de ellos. Los no metales son utilizados como aislantes térmicos en aplicaciones como la construcción de edificios y la fabricación de materiales ignífugos.
Variedad de colores
Los no metales pueden presentar una amplia variedad de colores. Esto se debe a la forma en que interactúan con la luz y la forma en que absorben y reflejan ciertas longitudes de onda. Por ejemplo, el oxígeno es un gas incoloro, mientras que el azufre puede ser amarillo o anaranjado, dependiendo de su forma molecular.
Principales diferencias entre metal y no metal
Estructura atómica
Una de las principales diferencias entre los metales y los no metales es su estructura atómica. Los metales tienen estructuras atómicas en las que los electrones se encuentran en una nube electrónica, mientras que los no metales tienen estructuras atómicas en las que los electrones están más cercanos al núcleo.
Enlace químico
Otra diferencia importante es el tipo de enlace químico que forman los metales y los no metales. Los metales generalmente forman enlaces metálicos, en los que los electrones se comparten entre los átomos, mientras que los no metales forman enlaces covalentes, en los que los electrones se comparten de manera más igualitaria.
Comportamiento frente a la electricidad
Los metales son buenos conductores de electricidad debido a la presencia de electrones libres en su estructura atómica. Por otro lado, los no metales son malos conductores de electricidad debido a que sus electrones están más fuertemente ligados a los átomos y no pueden moverse fácilmente.
Comportamiento frente al calor
Los metales son buenos conductores de calor, ya que los electrones libres pueden transferir energía térmica rápidamente. Por otro lado, los no metales son malos conductores de calor, ya que no tienen electrones libres y la transferencia de energía térmica es más lenta.
Resistencia a la corrosión
Los metales pueden corroerse cuando están expuestos a ciertos elementos o compuestos en su entorno, como el oxígeno y la humedad. Por otro lado, los no metales son más resistentes a la corrosión y no sufren el mismo deterioro que los metales.
Usos comunes de los metales
Industria automotriz
Los metales, como el acero y el aluminio, son ampliamente utilizados en la industria automotriz para la fabricación de carrocerías, motores y componentes estructurales debido a su resistencia y durabilidad.
Construcción
En el sector de la construcción, los metales, como el acero y el hierro, se utilizan en la fabricación de estructuras, vigas, columnas y otros elementos debido a su resistencia y capacidad de soportar grandes cargas.
Electrodomésticos
Los metales, como el cobre y el aluminio, se utilizan en la fabricación de electrodomésticos, como refrigeradores y hornos, debido a su alta conductividad térmica y eléctrica.
Electrónica
Los metales, como el oro, la plata y el cobre, se utilizan en la fabricación de componentes electrónicos, como circuitos integrados y cables, debido a su alta conductividad eléctrica.
Joyas y bisutería
Los metales preciosos, como el oro y la plata, se utilizan en la fabricación de joyas y bisutería debido a su belleza estética y su resistencia a la corrosión.
Usos comunes de los no metales
Fabricación de plásticos
Los no metales, como el carbono y el oxígeno, se utilizan en la fabricación de plásticos debido a su capacidad de formar enlaces covalentes y su versatilidad en la modificación de propiedades físicas y químicas.
Producción de vidrio
El sílice, un no metal, se utiliza en la producción de vidrio debido a su alta resistencia y su capacidad de fundirse a altas temperaturas.
Industria química
Los no metales, como el carbono y el nitrógeno, se utilizan en la industria química para la fabricación de productos químicos, como fertilizantes, plásticos y medicamentos.
Medicina y farmacia
Los no metales, como el oxígeno y el azufre, se utilizan en la medicina y farmacia para la fabricación de medicamentos y productos de cuidado personal debido a sus propiedades químicas y biológicas.
Textiles
Los no metales, como el algodón y el poliéster, se utilizan en la industria textil para la fabricación de prendas de vestir y productos textiles debido a sus propiedades físicas y su capacidad de absorber y liberar humedad.
Metales y no metales en la tabla periódica
Posición de los metales en la tabla periódica
Los metales se encuentran en la parte izquierda de la tabla periódica, en los grupos 1 a 12, excepto el hidrógeno, que es un no metal. Estos elementos se caracterizan por tener baja electronegatividad y alta conductividad eléctrica y térmica.
Posición de los no metales en la tabla periódica
Los no metales se encuentran en la parte derecha de la tabla periódica, en los grupos 13 a 18, excepto el hidrógeno. Estos elementos se caracterizan por tener alta electronegatividad y baja conductividad eléctrica y térmica.
Propiedades de los elementos de transición
Los elementos de transición son metales que se encuentran en los grupos 3 a 12 de la tabla periódica. Estos elementos tienen propiedades intermedias entre los metales y los no metales, como conductividad eléctrica y térmica moderada y variabilidad en sus estados de oxidación.
Propiedades de los metaloides
Los metaloides, también conocidos como semimetales, son elementos que se encuentran en la zona media de la tabla periódica, formando una línea diagonal entre los metales y los no metales. Estos elementos tienen propiedades tanto metálicas como no metálicas y se utilizan en aplicaciones como semiconductores y materiales para pantallas electrónicas.
Reacciones químicas de metales y no metales
Reacciones de oxidación y reducción
Los metales tienen una alta tendencia a perder electrones, lo que los hace propensos a reacciones de oxidación, donde ceden electrones, mientras que los no metales tienen una alta tendencia a ganar electrones, lo que los hace propensos a reacciones de reducción, donde ganan electrones.
Formación de sales
Los metales pueden reaccionar con los no metales para formar sales. Por ejemplo, el sodio, un metal, reacciona con el cloro, un no metal, para formar cloruro de sodio, una sal común.
Formación de compuestos covalentes
Los no metales pueden formar compuestos covalentes, en los que los electrones se comparten de manera más igualitaria entre los átomos. Estos compuestos se forman cuando dos o más átomos no metálicos se unen mediante enlaces covalentes, como el agua (H2O) y el dióxido de carbono (CO2).
Interacción con ácidos y bases
Los metales suelen reaccionar con los ácidos para formar sales y liberar hidrógeno. Por otro lado, los no metales pueden reaccionar con las bases para formar sales y agua.
Comportamiento frente a los agentes oxidantes
Los metales pueden reaccionar con agentes oxidantes, como el oxígeno, para formar óxidos metálicos. Por otro lado, los no metales pueden reaccionar con agentes oxidantes para formar óxidos no metálicos.
Conductividad eléctrica y térmica
Explicación de la conductividad eléctrica en metales
La conductividad eléctrica en los metales se debe a la presencia de electrones libres en su estructura atómica. Estos electrones pueden moverse fácilmente a lo largo del material y llevar la corriente eléctrica.
Explicación de la conductividad eléctrica en no metales
Los no metales no tienen electrones libres en su estructura atómica, lo que dificulta el flujo de corriente eléctrica. Por lo tanto, los no metales son malos conductores de electricidad.
Explicación de la conductividad térmica en metales
La conductividad térmica en los metales se debe a la capacidad de los electrones libres para transferir energía térmica rápidamente a lo largo del material. Esto permite una rápida dispersión del calor.
Explicación de la conductividad térmica en no metales
Los no metales no tienen electrones libres y la transferencia de energía térmica es más lenta en comparación con los metales. Por lo tanto, los no metales son malos conductores de calor.
Metaloides
Características de los metaloides
Los metaloides, también conocidos como semimetales, son elementos que tienen características tanto de los metales como de los no metales. Estos elementos tienen una conductividad eléctrica y térmica intermedia, así como una variabilidad en sus estados de oxidación.
Ejemplos de metaloides
Algunos ejemplos de metaloides son el silicio, el germanio, el arsénico y el antimonio.
Usos de los metaloides
Los metaloides se utilizan en aplicaciones como semiconductores electrónicos, paneles solares, materiales para pantallas y fibras ópticas, debido a su capacidad para controlar el flujo de electricidad y luz.
Metalurgia
Procesos de extracción de metales
La metalurgia es la ciencia y tecnología de la extracción y procesamiento de metales a partir de minerales. Este proceso implica diferentes etapas, como la trituración, molienda, concentración y refinación de minerales para obtener los metales deseados.
Transformación de los metales
Una vez que los metales son extraídos, pueden ser sometidos a diferentes procesos de transformación, como la fundición, laminación, forja y soldadura, para darles forma y mejorar sus propiedades físicas y mecánicas.
Aplicaciones de la metalurgia
La metalurgia tiene una amplia gama de aplicaciones en diferentes industrias, como la automotriz, la construcción, la electrónica, la aeronáutica y la energía, entre otras. Estos sectores dependen de la producción y transformación de metales para fabricar productos y componentes.
Conversión de metales a no metales
Procesos de oxidación de los metales
La oxidación es un proceso químico en el que los metales reaccionan con el oxígeno para formar óxidos metálicos. Este proceso puede ocurrir de manera natural, como en la oxidación del hierro para formar óxido de hierro (óxido de hierro), o puede ser inducido por medios químicos o electroquímicos.
Formación de óxidos
Los óxidos son compuestos químicos formados por la combinación de un metal con oxígeno. Estos compuestos pueden tener diferentes propiedades y aplicaciones, como la protección contra la corrosión en metales o la producción de pigmentos para la industria de la pintura.
Formación de compuestos iónicos
Los metales pueden reaccionar con no metales para formar compuestos iónicos. En estas reacciones, los metales ceden electrones para formar iones positivos, llamados cationes, mientras que los no metales ganan electrones para formar iones negativos, llamados aniones. Estos iones se atraen entre sí mediante fuerzas electrostáticas y forman compuestos iónicos, como las sales.
Intercambio iónico
Reacciones de intercambio iónico en metales
El intercambio iónico en metales puede ocurrir cuando un metal reacciona con una solución que contiene iones de otro metal. En estas reacciones, los iones de los metales se intercambian entre sí, formando diferentes compuestos metálicos.
Reacciones de intercambio iónico en no metales
El intercambio iónico en no metales puede ocurrir cuando un no metal reacciona con una solución que contiene iones de otro no metal. En estas reacciones, los iones de los no metales se intercambian entre sí, formando diferentes compuestos no metálicos.
Conclusión
Los metales y los no metales son dos categorías principales de elementos químicos con propiedades y características diferentes. Los metales destacan por su conductividad eléctrica y térmica, su maleabilidad y ductilidad, y su brillo metálico. Por otro lado, los no metales son opacos, tienen baja conductividad eléctrica y térmica, y pueden presentar una amplia variedad de colores. Ambos tipos de elementos tienen usos comunes en diferentes industrias y su comportamiento químico varía en reacciones de oxidación, formación de sales y compuestos covalentes. La comprensión de estas diferencias y propiedades es fundamental para comprender la química y sus aplicaciones en la vida cotidiana.
Preguntas frecuentes
¿Cuál es la diferencia entre un metal y un no metal?
La diferencia principal entre un metal y un no metal radica en sus propiedades físicas y químicas. Los metales son buenos conductores de electricidad y calor, son maleables y brillantes, mientras que los no metales son malos conductores, son opacos y pueden tener una amplia variedad de colores.
¿Cuáles son las propiedades más importantes de los metales?
Las propiedades más importantes de los metales son su conductividad eléctrica y térmica, su maleabilidad, ductilidad y brillo metálico.
¿Cuáles son las principales características de los no metales?
Las principales características de los no metales son su opacidad, baja conductividad eléctrica y térmica, y variedad de colores.
¿Por qué los metales son buenos conductores de electricidad?
Los metales son buenos conductores de electricidad debido a la presencia de electrones libres en su estructura atómica, que pueden moverse fácilmente y llevar la corriente eléctrica.
¿Cuáles son los usos más comunes de los no metales?
Los no metales tienen usos comunes en la fabricación de plásticos, producción de vidrio, industria química, medicina y farmacia, y textiles.
Deja una respuesta
Entradas relacionadas